04月14日-04月16日,北京
中国MDR Regulation 2017/745
我们诚挚邀请您参加于2021年04月14日-04月16日由TÜV南德意志集团医疗健康服务部门在北京举办的欧盟医疗器械新法规MDR专题培训。
会议背景
2017年5月,欧盟医疗器械新准入法规MDR (REGULATION EU 2017/745) 颁布,新的法规将替代原有的医疗器械指令 (MDD 93/42/EEC) 和有源植入性医疗器械指令 (AIMD 90/385/EEC)。
欧盟医疗器械新法规 (MDR)
新法规MDR在各方职责、产品分类、符合性评估途径、临床数据等方面都做出了重大改变,提出了很多新的、更高的要求。已通过MDD CE认证的产品,也需要重新评估后才能获得MDR CE证书。此次重大变更,虽然欧盟新法规允许企业有3年的过渡期,但实际企业有很多转换工作需要执行。而过渡期即将结束,如何才能满足新法规的要求,已成为中国制造商面对的巨大挑战。
我们希望借助此次MDR专题培训,结合法规的最新要求指引,让企业对于MDR的过渡期及欧盟新准入法规要求有更加清晰了解,以评估潜在企业合规问题,及时着手制定解决潜在问题的计划,从而确保及时向新法规顺利过渡。
与会者通过考试后将获得一张由我司颁发的MDR培训证书
目标学员
讲师介绍

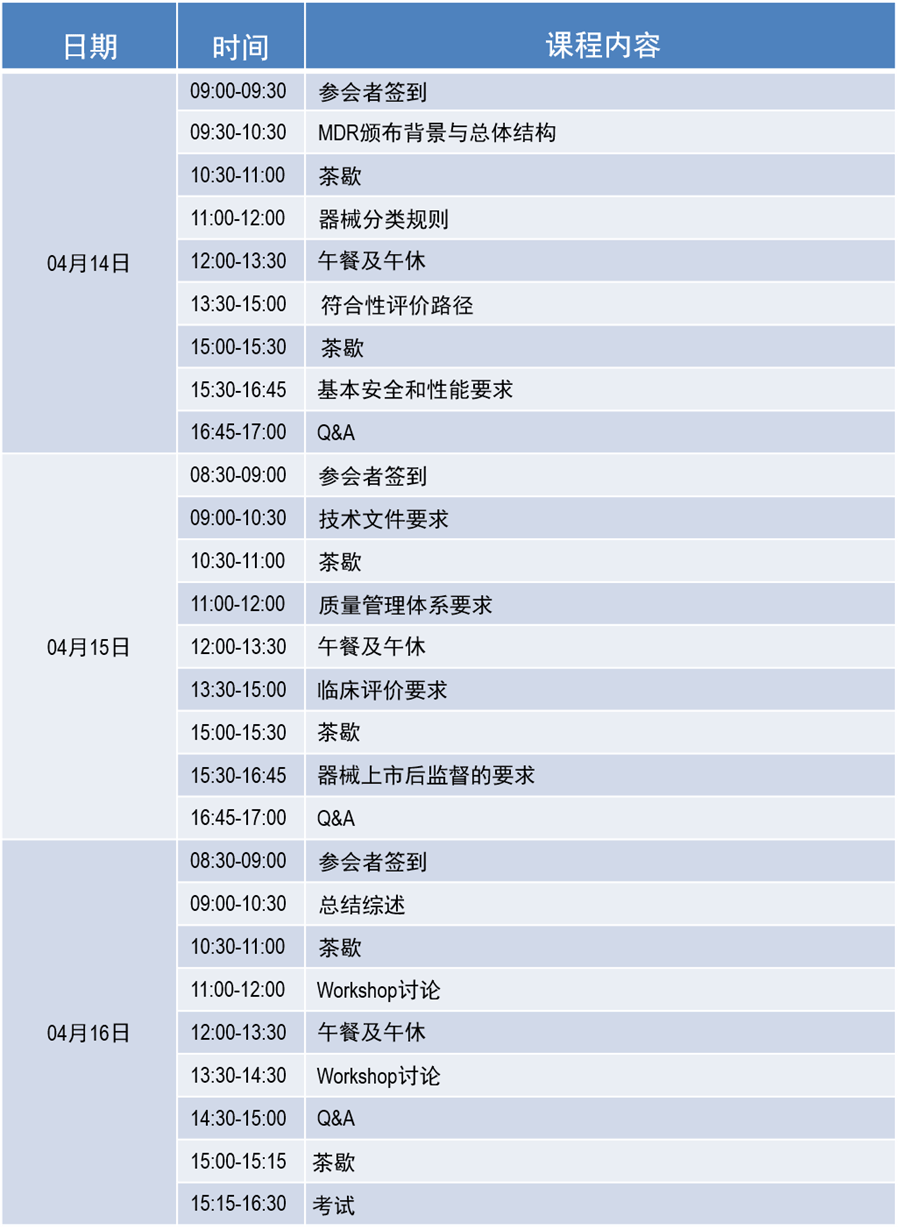
日程安排

课程安排
报名方式
您可扫码关注,即刻报名!

或直接联系:
陈雪 女士
电话:+86 10 6455 0146
邮箱:xue.chen@tuvsud.com
Site Selector
Global
Asia
Europe
Middle East and Africa
